【建模文章解读 】 采用系统定量毒理学评估因小分子化合物导致线粒体损伤和胆汁酸毒性,而出现肝毒性呈现种属差异
原文作者
Grant Generaux1, Vinal V. Lakhani1, Yuching Yang1, Sashi Nadanaciva2, Luping Qiu3, Keith Riccardi4, Li Di4, Brett A. Howell1,, Scott Q. Siler1,, Paul B. Watkins5,6, Hugh A. Barton7, Michael D. Aleo3, Lisl K. M. Shoda1
1 美国DILIsym Services 公司
2 美国辉瑞制药公司,全球药物化学部
3 美国辉瑞制药公司,药物安全研究与开发部
4 美国辉瑞制药公司,医药科学部
5 美国北卡罗来纳大学教堂山分校,埃舍曼药学院
6 美国北卡罗来纳大学教堂山分校,药物安全科学研究所
7 美国辉瑞制药公司,生物医学设计部
导 读
FDA当前非常鼓励制药企业使用模型的方法评估在研化合物特性,以提高药物的安全性。本次解读的案例:采用定量毒理学软件DILIsym重现了PF-04895162种属差异性的肝毒性结果,解释了化合物在人体产生肝毒性的原因。通过案例学习,可了解如何通过DILIsym定量评估肝损伤。
案例摘要
该案例说明如何采用DILIsym软件(一款评估肝损伤的定量毒理学计算工具)重现PF-04895162 (ICA-105665)导致的种属差异性肝毒性。PF-04895162是开发用于治疗癫痫症的药物,由于在健康志愿者中观测到氨基转移酶的升高而被迫终止(NCT01691274),然而在临床前安全性研究中并没有发现肝脏安全性的问题。整合表征肝毒性机制以及预测体内肝脏暴露的体外数据到DILIsym软件中,重现该化合物的临床肝毒性与未在大鼠身上发现肝毒性的情况。从多重维度上模拟考察差异性,并发现人体肝脏暴露要高于大鼠。模拟结果提示人体肝毒性是因为化合物同时造成了线粒体毒性和胆汁酸转运体的抑制(假设去除上述一项机理都可以使其肝损伤消除)。模型表明更高的PF-04895162肝脏暴露(比大鼠安全性试验给药剂量时的暴露更高)时,会加重线粒体损伤但依然不会导致大鼠肝毒性,这是因为该种属不能有效地积累产生细胞毒素的胆汁酸。这些研究提示联合体外数据和计算机筛选的方法可以鉴定潜在肝毒性的风险,并为类似的前瞻性研究奠定的基础。
推荐理由
很多临床前看上去很有前景的化合物,但由于临床的安全性(包括肝脏毒性)问题而被终止。本案例联合体外数据(表征肝毒性的机制性参数以及预测肝脏暴露的模型数据)和DILIsym软件(定量评估肝损伤的模型软件),重现化合物PF-04895162种属差异性的肝毒性结果,并解释了该化合物在人体产生肝毒性的原因。通过研究工作,说明模型可以准确反映观测结果,并为其它药物的肝毒性评估工作奠定了基础。此外,该工作也可用于详细学习DILIsym的模型搭建、模型参数、结果分析等知识。
软件用途
案例中,利用DILIsym软件搭建PF-04895162肝损伤评估模型。考察了化合物在肝脏的暴露(通过生理药代动力学PBPK模型进行预测)、可能产生肝毒性的一种或多种机理(多重维度进行分析确认)等相关因素重现PF-04895162种属差异性的肝毒性结果。通过模型的开展,发现化合物同时造成了线粒体毒性和胆汁酸转运体的抑制,进而产生了人体的肝毒性(去除其中一个机理都会使得肝毒性消除);而大鼠由于不能有效累积胆汁酸,因此即使比安全性更高的肝脏暴露也仅加重线粒体的损失,但不会直接产生肝毒性。
1 研究背景
FDA提出创新监管科学计划(ARSI)作为改善监管科学质量和效率的战略计划,此项战略的一个方面便是开发计算方法和数学模型以提高药品的安全性。DILIsym软件应用定量系统毒理学(QST)方法评估药物性肝损伤,现已成功用于解释临床肝信号的数据。此外,DILIsym还能重现大鼠与人肝毒性的种属差异性。
PF-04895162 (ICA-105665,由Icagen公司发现)是开发用于治疗癫痫病的全新小分子化合物。PF-04895162在多个临床前种属进行了安全性评估:大鼠给药7天的毒性试验中,丙氨酸氨基转移酶(ALT)的水平呈现剂量的相关性,提示有潜在的肝毒性;然而并没有检测到肝损伤的组织学变化证据,且在7天给药的重现研究中未再观察到ALT的水平变化。大鼠28天和6个月的毒性试验也未发现氨基转移酶的水平变化和肝脏毒性;猕猴9个月的毒性研究结果也显示阴性的肝毒性结果。总之,临床前的研究未发现肝脏可能是该化合物安全性问题的靶器官。
在临床研究中,健康志愿者单次给药剂量爬坡至600 mg或多次给药剂量爬坡至每天两次给药200 mg (BID, 共7天)均未发现有明显数据(如ALT > 3x ULN)说明PF‐04895162会造成肝损伤。另外一个7天给药的研究中,12个志愿者250 mg BID或300 mg BID给药后发现一例ALT的升高。但意外的是,14天给药的研究,8个志愿者300 mg BID给药后有6例出现了ALT的升高,甚至高达5x正常值的上限(ULN);这项研究也直接导致了该化合物开发计划的中止。
因此本工作选择PF‐04895162作为DILIsym软件评估种属差异性肝毒性的潜在案例,联合肝毒性机制和预测体内暴露的体外数据至DILIsym中以预测肝毒性。特别测定了PF‐04895162与线粒体功能、化合物与胆汁酸转运体相作用的体外数据;通过生理药代动力学(PBPK)模型预测化合物在大鼠及人体内的暴露。模拟结果发现可以重现该化合物在临床人群的肝毒性,但非临床种属无肝毒性的结果。此外,模拟发现人体肝毒性是由于该化合物同时导致了线粒体损伤和胆汁酸毒性,去除其中一个机理都不会使得ALT的升高。最后模型设置的剂量方案以及肝毒性的不确定性也均和临床与动物观测结果一致。该案例也说明了DILIsym软件可以用于鉴定潜在的人体肝毒性风险。
2 建模数据与处理
2.1 体外表征肝毒性机制的实验
为了机制性地模拟PF-04895162介导的肝损伤,收集了体外表征PF-04895162与线粒体毒性、胆汁酸转运体、氧化应激相互关系的数据。当前研究所采用的数据来自先前的报道,且未观察到PF-04895162会产生氧化应激。采用DILIsym的胆汁酸及线粒体子模型进行模拟,相关的毒性数据汇总如下:
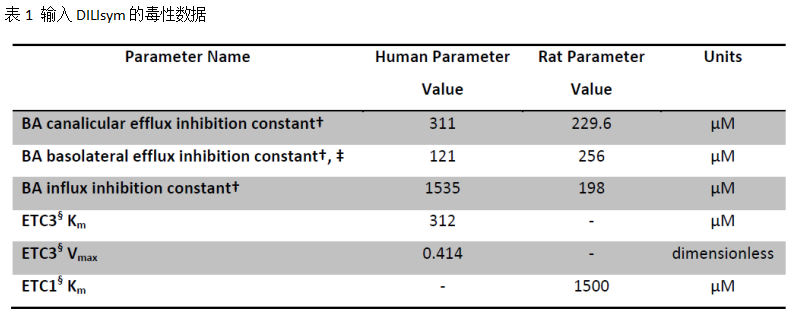

胆汁酸转运体毒性数据:通过标准的囊泡转运实验测定PF-04895162对人BSEP, MRP3和MRP4以及大鼠Bsep和Mrp3等转运体的半数抑制浓度(IC50);假如测定的抑制浓度达不到抑制50%,则外推曲线计算IC50;然后将测定或外推的数据直接用于DILIsym。如果不存在抑制常数(Ki)的数据,DILIsym通常的做法是选择α=5以表征为混合的胆汁酸抑制特性。实验结果发现PF-04895162对人或大鼠胆汁酸转运体的作用具有浓度依赖性:PF-04895162抑制人外排转运体MRP4、未能直接测到外排转运体BSEP及 MRP3的IC50 (不能有效抑制)、也未能测到摄取转运体NTCP的IC50;PF-04895162能够抑制大鼠Mrp3及Bsep外排转运体、对摄取转运体Ntcp的IC50也外排转运体相近。
线粒体毒性数据:为了表征潜在的大鼠及人线粒体毒性,将不同浓度的PF-04895162与大鼠及人肝细胞孵育24小时。实验结果表明该化合物对基础耗氧量(OCR)具有微弱的影响,24小时内OCR基本没有下降;当加入羰基氰对三氟甲氧基苯腙(FCCP)后,发现化合物对肝细胞OCR的作用呈现剂量依赖性;这些结果提示化合物可能是线粒体电子传递链(ETC)的轻微抑制剂;为准确描述作用部位处化合物浓度与效应之间的关系,测定了化合物在肝细胞内的浓度,发现结果要远高于理论的平均浓度。MITOsym模块用于再处理所测定的Seahorse数据(也即体外测定的PF-04895162线粒体毒性的数据),然后采用一个转换因子将MITOym的参数转为DILIsym的体内数据。
2.2 PBPK建模
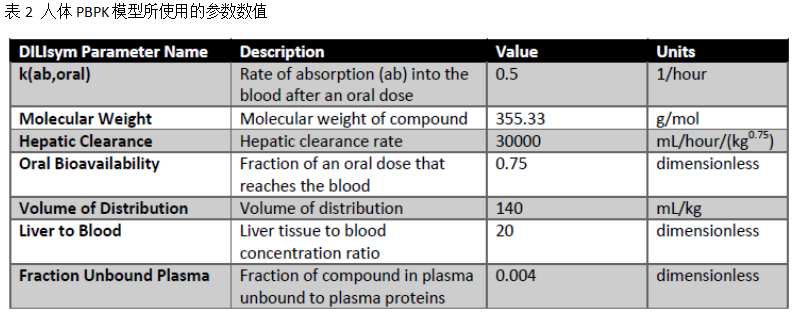
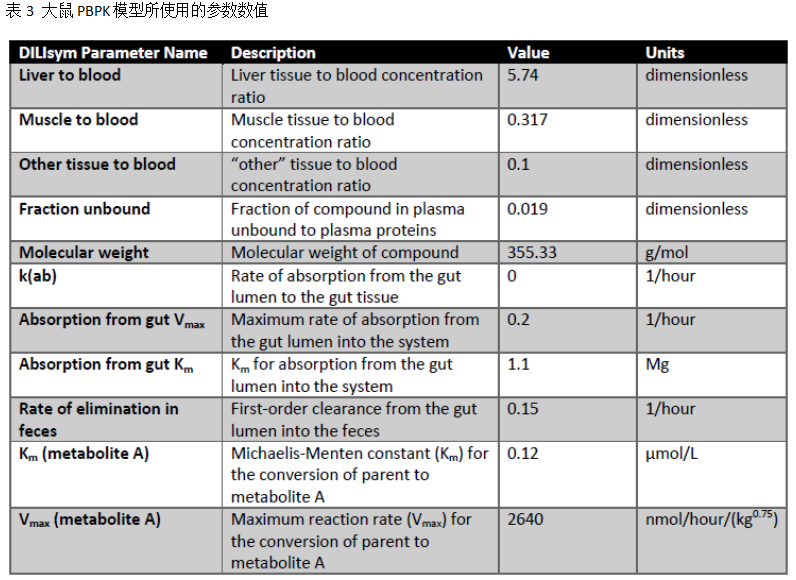
采用DILIsym的PBPK子模型重现PF-04895162在大鼠及人观测的血浆浓度-时间曲线。最为简化的PBPK模型可以用于表征每个个体(人)的PK行为;由于口服给药后存在肠道饱和吸收,因此需要采用稍微复杂些的PBPK模型表征大鼠的PK特性。大鼠PBPK子模型包含了血液、肝脏、肌肉、肠道和其它组织、人体的模型则仅包含了血液和肝脏两个房室(剩余的器官则全部纳入系统分布体积中);两个种属的子模型,均采用血流限速型的组织。相关设置及优化的模型参数如下表所示:
2.3 模拟个体的基线值
个体模拟的基线值采用人体测量学及生物化学性质的平均值,再基于基线值优化大鼠及PBPK子模型。
2.4 Human SimCohorts
SimCohorts是比SimPops数据集稍少的虚拟个体(n = 16),本工作选择了Human_ROS_apap_mito_BA_v8A_1_Multi16_A SimCohort,包含了线粒体功能损伤、胆汁酸淤积、氧化应激等个体敏感的参数,并用于研究肝毒性的机理。模型开展多种方式的研究,如果整合PF-04895162所有的毒性机理、仅不存在线粒体功能损伤、仅不存在胆汁酸毒性等情况;当不存在某一项机理时,查看PF-04895162产生临床个体ALT水平升高的情况,并分析对临床肝毒性的贡献。
2.5 SimPops
SimPops收集了反映人体测量学及生物化学等参数变异的虚拟个体。本工作所有人体的模拟是基于Human_ROS_apop_mito_BA_v8A_1 (n = 285) SimPops进行的,其中健康志愿者的体重、线粒体功能、半胱天冬酶的激活(细胞凋亡)、胆汁酸转运体的表达、氧化应激等参数的群体分布见支持文件;大鼠的模拟则基于Rat_ROS_apop_mito_BA_v8A_11 (n = 294) SimPops进行的,相关模型参数的群体分布也见支持文件。
2.6 模拟方案
优化大鼠PBPK模型的模拟方案为:1 mg/kg IV或10, 30, or 100 mg/kg/day每天口服给药一次至28天;优化人PBPK模型的给药方案为:300 mg单次口服给药,并使用300 mg每天口服给药两次(BID)测试了建立的模型。对于肝毒性研究,模拟了大鼠100 mg/kg/day口服给药至28天;人则考察了300 mg BID口服给药至14天,并紧接着一个14天的清洗期。人体还模拟了200 mg BID口服给药至7天,以重现早期临床研究中未发现肝毒性的结果。
2.7 多重线性回归分析
为了更好地理解具体哪个机制参数对血浆ALT升高更有显著意义,采用R进行了多重线性回归分析。由于SimPops中不同参数的数量级处于一个较大的范围内,所以将SimPops中的每个参数值除以其最大值进行归一化处理,使得所有参数的范围都落在0-1之间。
3 模型结果与分析
3.1 大鼠和人PBPK模型的优化
大鼠的PBPK模型是根据静脉及口服给药的观测结果进行优化,优化过程中直接使用了实验值或者考察一定范围内变化的影响,最终得到的血浆浓度-时间曲线和观测结果较为一致,如下图所示:
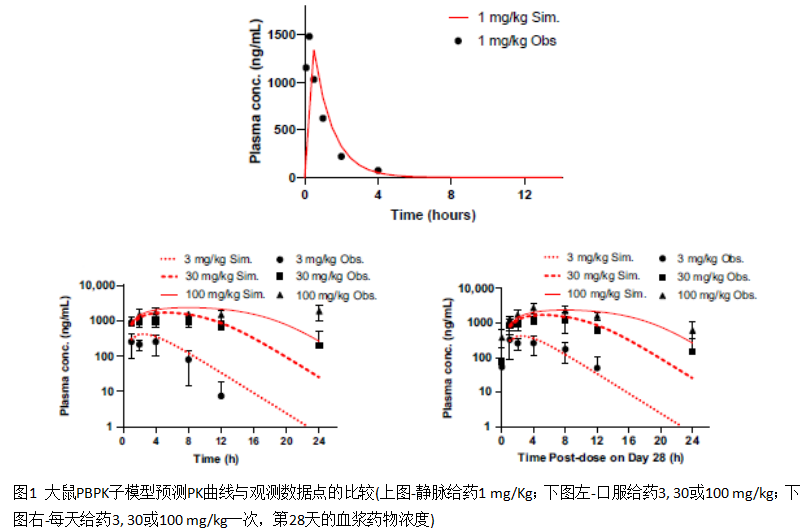
人体PBPK子模型也根据口服给药300 mg后的血药浓度-时间数据进行优化,优化后的模型结果也可以和单次及14天多次给药的结果吻合一致,如下图所示:


此外,还进一步得到了大鼠及人肝脏平均的浓度-时间曲线,如下图。模拟的大鼠肝脏与全血浓度比与大体体内定量全身放射自显影技术(QWBA)的数据进行了对比,以确定模拟的肝脏浓度与测定数据一致。当然,没有获得相应人体肝脏的浓度数据,因此预测的肝脏浓度与体外肝细胞实验测定细胞内浓度进行了对比。
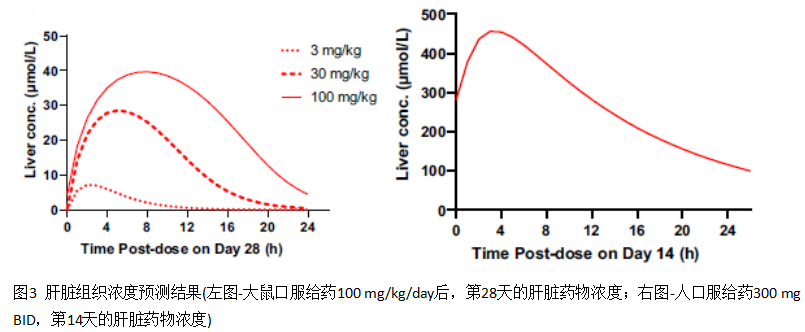
3.2 大鼠肝毒性的模拟
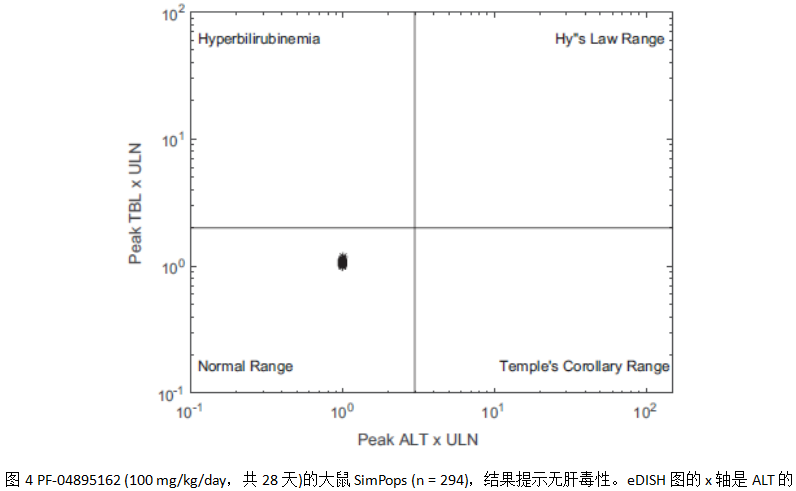
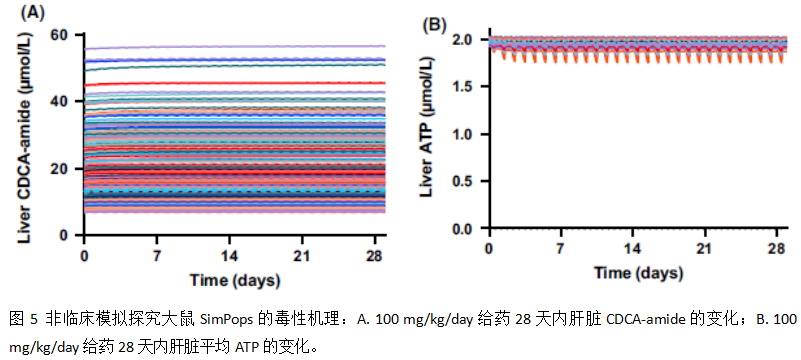
按照制定的模拟方案,整合大鼠PBPK子模型以及两个推测的毒性机理(线粒体损伤及胆汁酸转运体抑制)进行了大鼠的群体模拟,模拟结果发现与临床前结果一致,未发现PF‐04895162具有肝毒性,如下图4 (评估药物诱导严重肝毒性, eDISH,该图是典型地评估化合物临床肝脏安全性的方式)。还进一步研究了胆汁酸和ATP的动力学变化,发现肝毒性的胆汁酸鹅去氧胆酸-氨基化合物(CDCA-amide)的水平未发生较大影响、肝脏ATP的水平仅有轻微的下降,如下图5。

3.3 人体肝毒性的模拟
人体模拟的eDISH图显示PF‐04895162对人具有肝毒性。人体SimPops的预测结果:ALT > 1x ULN的比例为21% (59/285), ALT > 5x ULN的比例为11% (32/285), ALT > 10x ULN的比例为6% (18/285); 胆红素上升并超出2x ULN的比例为3% (9/285);而临床观测的结果为:ALT > 1x ULN的比例为75% (6/8), ALT > 5x ULN的比例为12% (1/8), ALT > 10x ULN的比例为0% (0/8);此外也观测到两例受试者的总胆红素水平介于1 x 和2x ULN。因此当前大鼠与人体的肝毒性模拟结果与观测数值基本吻合;和I期多剂量给药的少数受试者结果相比,模拟的结果在ALT轻微变化阶段的比例要少一些,另外严重肝损伤的比例要高一些。
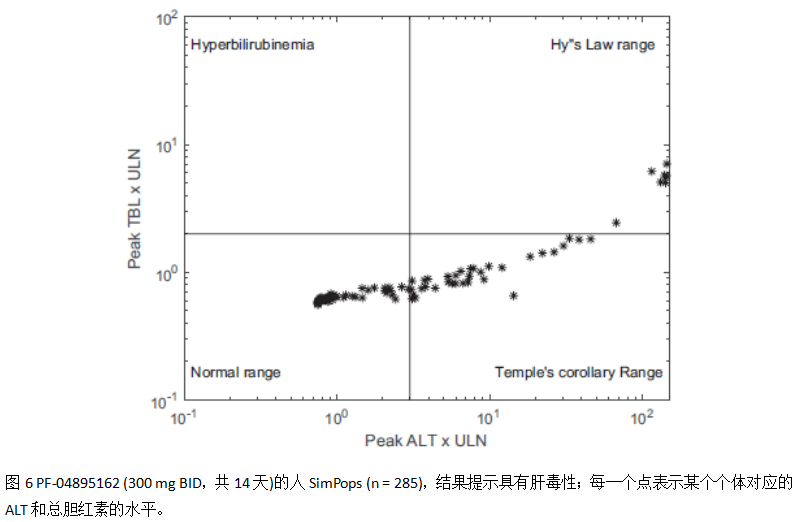
模拟发现有9例个体(9/285, 3%)将发生严重的肝损伤(ALT > 3x ULN, total bilirubin > 2x ULN),这个模拟指标对应临床严重肝损伤的响应为Grade 3 ALT升高(5-10x ULN),且不伴随胆红素的升高。通过多重线性回归分析发现SimPops中的体重是PF-04895162体内暴露的协变量;此外胆汁酸微管外排能力的降低将显著影响血浆中ALT的水平。
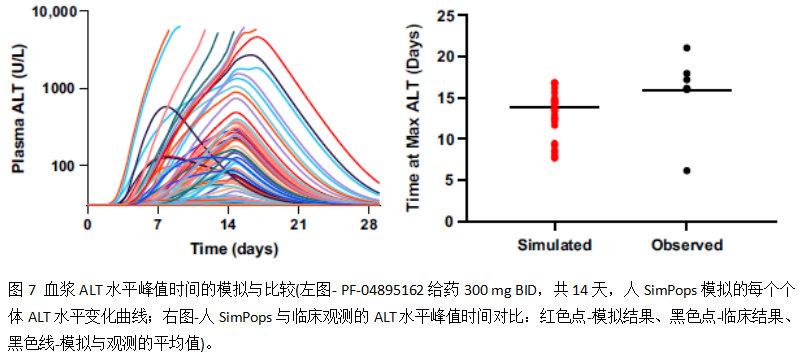
DILIsym模拟的血浆ALT水平峰值时间(下图7)和临床结果也较为一致:临床试验中,受试者的ALT水平峰值时间分布于6.2到21天(大部分介于14到19天),平均时间为16天;人SimPops的模拟结果分布于7.7到16.8天,平均时间为14.2天。
3.4 人体肝毒性的机理探讨
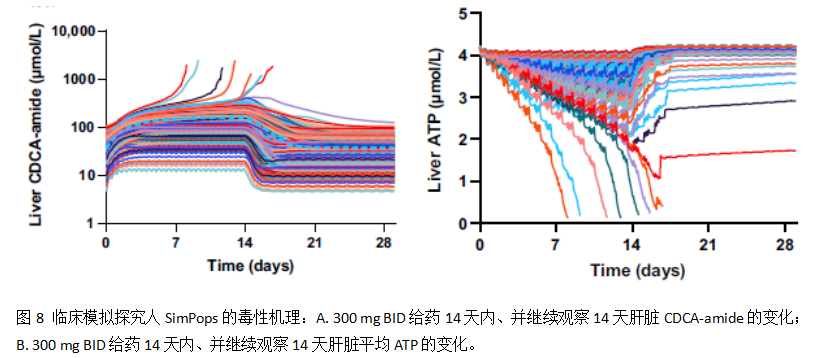
进一步机制性地研究了人体模型的ATP和胆酸盐的动力学,发现与大鼠结果相比,肝脏ATP的水平呈现显著地下降、胆汁酸CDCA-amide也显著上升。结果见下图8所示:
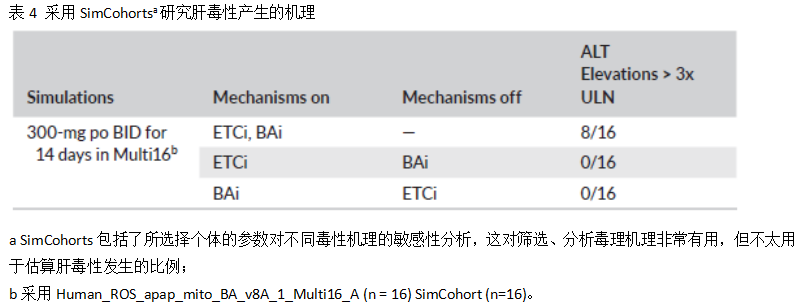
此外还选择了小样本量的SimCohort (n=16),考察ETC抑制或胆汁酸转运体抑制关闭的情况下,对肝毒性预测结果的影响,以具体分析造成人肝毒性的主要机制,结果见表4。比较有趣的是,当去除PF-04895162介导的ETC抑制或转运体抑制两者中的一个机制,模拟结果都无法展现ALT水平的升高。这些研究表明,PF-04895162在抑制ETC的同时,也抑制BSEP,从而共同产生肝脏毒性(即使化合物对BSEP的亲和力较弱,IC50=311 μmol/L)。
4 模型讨论
肝脏暴露对毒性的影响:肝脏的药物暴露量会影响肝毒性的预测结果,当前模型预测的人体肝脏暴露高于大鼠。虽然采用了不同的数据对大鼠及人肝脏暴露进行了验证,但似乎也可能人体肝脏实际暴露会低于模型预测结果(导致人体模型肝毒性的结果出现假阳性),此种情况存在可能性但又无法真实获知。由于存在大鼠体外肝细胞内的浓度数据,因此搭建了大鼠的PBPK模型(同时吻合观测血浆及肝细胞内的浓度,肝细胞内浓度高于体内QWBA的数值),并基于此模型考察了大鼠肝脏浓度(高估)以及肝毒性的情况,结果发现该化合物依然对大鼠没有明显的肝毒性。
人体低剂量给药后,未发现肝毒性:模型也考察了200 mg BID,共7天给药的肝毒性情况(一个24个受试者的小临床试验采用了该给药方案,且未观察到ALT超过3x ULN),人体SimPops的结果提示绝大部分(283/285)都无肝毒性特征,且两个个体的ALT超过了3x ULN。此外,170 mg BID,共7天给药的模拟结果,发现无任何个体的ALT大于3x ULN。这些模拟的结果与临床观测现象基本一致,同时也说明了该化合物剂量依赖性的肝毒性特征。
模型表明ALT有滞后现象,这反映PF-04895162介导胆汁酸转运体抑制后,初始不能有效积累胆汁酸以引起毒性。此外,模拟还发现在不加入自适应免疫响应时,PF-04895162给药后将近2周才达到ALT水平的峰值。这些滞后的毒性说明PF-04895162可能表现为固有型肝损伤。
模型虽然能重现PF-04895162种属差异性的肝损伤,以及肝毒性的滞后现象,但ALT变化比例、升高的数值等也有观测结果有部分差异。除了当前模型已排除的一些机理,也可能存在部分DILIsym未纳入的机理;此外对比的观测数据来自样本量较少(n=8)小临床试验;同时当前的模型也未添加自适应免疫响应(体外缺少定量表征该机理的数据);最后当前的模拟也未考虑临床监测的情况:不管是否出现了肝损伤的信号,模型都将继续运行直到肝细胞的损失量超过80%以上。
5 总结
该工作采用PK数据和考察肝毒性机理的体外数据,重现了PF-04895162种属差异性的肝毒性结果,包括表征ALT水平升高的滞后现象。机制性的模型说明该化合物抑制胆汁酸转运体引起细胞内胆汁酸的积累,进而诱导线粒体的毒性;此外还连同了ETC抑制破坏线粒体的功能(两者共同作用,其中一个都无法造成ALT水平的变化)。该工作也为后续类似的案例模拟提供了研究基础,通过DILIsym软件这种QST的机制性模型可以很好地评估药物肝毒性的特征。
6 应用软件与模块
该案例应用的软件是DILIsym (v8A),并基于此版本设定大鼠和人体人群(SimPops)的参数。
关于DILIsym软件
DILIsym是基于定量系统毒理学的计算机模型软件,运用微分方程来概括药物可能导致肝损伤的关键过程,通过改变参数来创建模拟的患者群体或动物,以反映遗传和非遗传性变异,现已广泛用于评估药物性肝损伤的特性。软件整合多个子模型(如肝细胞生命周期、线粒体功能损伤和毒性、胆汁酸的处置、生物标记物的释放等)到模拟过程中。此外,DILIsym还引入了生理药代动力学(PBPK)模型以表征药物的代谢与处置过程,反映体内暴露情况。DILIsym软件是由DILI-sim Initiative开发出来的,该群体是一个开放性、民办合作组织,汇集了学术、制药企业及US FDA等业内的科学家。DILIsym已经在多个上市前及上市药物中进行了测试,其在80%以上的预测病例中都是准确的。
参考文献
Grant Generaux, Vinal V. Lakhani, Yuching Yang, et al., Quantitative systems toxicology (QST) reproduces species differences in PF‐04895162 liver safety due to combined mitochondrial and bile acid toxicity. Pharmacol Res Perspect. 2019 Oct 9; 7(6): e00523. IF=2.052
延伸阅读
1. 视频 | 采用DILIsym软件评估药物性肝损伤DILI


